[研究成果] 石黒班の研究がScientific Reports誌にアクセプトされました!
2020.06.03
Tanno N, Kuninaka S, Fujimura S, Takemoto K, Okamura K, Takeda N, Araki K, Araki M, Saya H, Ishiguro K* : Phosphorylation of the Anaphase Promoting Complex activator FZR1/ CDH1 is required for Meiosis II entry in mouse male germ cell. Scientific Reports 10, 10094 (2020)
Phosphorylation of the Anaphase Promoting Complex activator FZR1/CDH1 is required for Meiosis II entry in mouse male germ cell
Nobuhiro Tanno1 2, Shinji Kuninaka2, Sayoko Fujimura3, Kazumasa Takemoto1, Kaho Okamura1, Naoki Takeda4, Kimi Araki4 , Masatake Araki4, Hideyuki Saya2, Kei-ichiro Ishiguro1*
1熊本大学発生医学研究所・染色体制御分野 2慶應義塾大学・先端医科学研究所 3熊本大学発生医学研究所リエゾンラボ 4熊本大学生命資源研究・支援センター
掲載誌:Scientific Reports , (2020) https://doi.org/10.1038/s41598-020-67116-0
Anaphase promoting complex/Cyclosome (APC/C)は体細胞分裂の細胞周期を駆動するE3ユビキチンリガーゼとして知られる。FZR1(CDH1)はAPC/Cに直接結合して基質選択性を与える活性化因子として働き、細胞周期進行に関連する様々なタンパク質を分解に導く。体細胞分裂型の細胞周期において、FZR1(CDH1)はCDKによるリン酸化によってAPC/Cとの結合および解離が制御される。FZR1(CDH1)はG2/M期におけるCDK活性の亢進によってリン酸化を受けるとAPC/Cから解離し、CDK活性が低レベルに保たれるG1期ではAPC/Cと結合してその活性化を制御する。CDKによるFZR1(CDH1)リン酸化が体細胞分裂の細胞周期の制御に極めて重要な役割を果たすことが酵母や培養細胞レベルの先行研究から知られていたが、哺乳類生体内における役割については不明な点が多い。
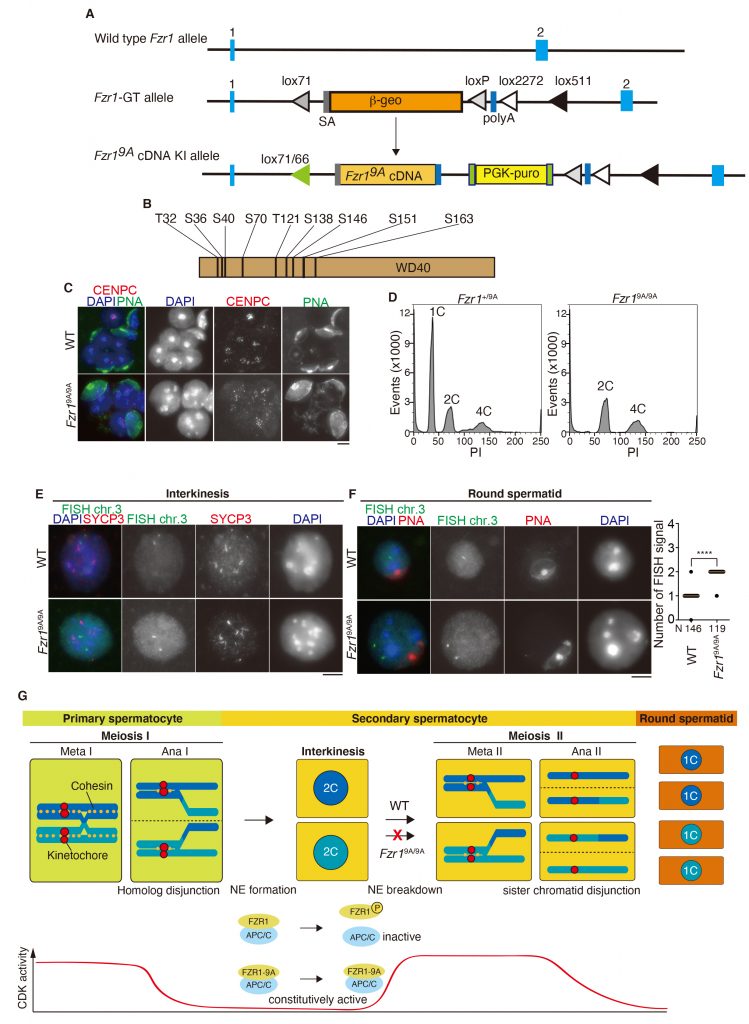
本研究では個体の組織・器官レベルでのFZR1(CDH1)リン酸化によるAPC/Cの活性制御の意義について検討を行った。FZR1(CDH1)内の9箇所のリン酸化部位にアラニン置換を導入し、非リン酸化型を模倣した変異FZR1-9Aを発現するノックインマウス (Fzr19A/9A KI)を作製した(図A, B)。この研究の開始当初、Fzr19A/9A KIマウスの体細胞分裂において非リン酸化型FZR1-9AがAPC/Cを恒常的に活性化することを予想していた。しかしながら、意外なことにFzr19A/9A KIマウスは体細胞組織における体細胞分裂に顕著な異常を示さなかった。予想外なことにFzr19A/9A KIマウスは精子形成に異常をきたして雄性不妊を示すことが判明した。非リン酸化型FZR1を発現するマウス精巣では第一分裂は正常に完了するものの最終的には精子前駆細胞と酷似したサイズの大きい細胞の蓄積を伴って停止していることが判明した(図C)。通常の野生型の精巣では円形精子前駆細胞に相当するDNA content 1Cの細胞集団が確認されるのに対して、Fzr19A/9A KIマウスでは半数体1Cに相当する細胞集団が観察されなかった(図D)。したがってFzr19A/9Aノックインマウスで蓄積する巨大な円形精子前駆細胞は減数第二分裂を正常に経ていない可能性が示唆された。さらにimmuno-FISH法を用いて減数第二分裂における染色体分配について検討を行った。その結果、Fzr19A/9A KIマウスの円形精子前駆細胞のほぼ全てにおいて姉妹染色分体の不分離が観察され、減数第二分裂への進行が起きていないことが明らかとなった(図E, F)。したがって雄の減数第二分裂への進行にはCDKによるFZR1リン酸化の制御が必要であると結論された(図G)。
興味深いことに、Fzr19A/9Aノックインマウス雌には顕著な生殖能の異常は観察されず、表現型に性差が見られる。雄の減数分裂では第一分裂と第二分裂との間に核膜再形成と染色体脱凝縮を伴う一過的な間期(interkinesis期)があるのに対して、雌にはそれに対応する時期が存在しない。おそらくCDKの高活性レベルが回復する第二分裂に先駆けて、Fzr19A/9Aノックインマウスでは恒常的に活性化されたAPC/Cが核膜崩壊と染色体再凝縮に必要とされるタンパク質を過剰に分解するために第二分裂への移行が障害されると考察された。