[研究成果] 有田班と鵜木(中西班)の領域内共同研究がJ Mol Biol誌にアクセプトされました!
2020.05.18
Kori S*, Jimenji T*, Ekimoto T*, Sato M, Kusano F, Oda T, Unoki M, Ikeguchi M, Arita K. (*These authors equally contributed to this work.) Serine 298 phosphorylation in linker 2 of UHRF1 regulates ligand-binding property of its tandem Tudor domain. J. Mol. Biol., 432 (14), 4061-4075 (2020)
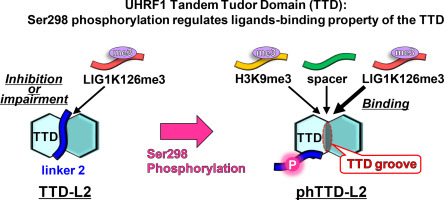
DNA維持メチル化に必須の因子であるUHRF1は5つの機能ドメインから構成されるマルチドメインタンパク質で、ヘミメチル化DNAのみでなく、様々なタンパク質と相互作用する。UHRF1のtandem Tudor domain (TTD)には、UHRF1分子内のlinker2やspacerと名付けられたドメイン間リンカーとの結合や、 H3K9me3およびLIG1K126me3との分子間相互作用に寄与するpeptide-binding grooveが存在する。TTDのpeptide-binding grooveにはUHRF1のlinker2が優先的に結合することを以前に示したが (Arita et al., PNAS, 2012)、TTDがどのような機構で結合相手を選択しているかは不明な点が多かった。
本研究では、UHRF1のlinker2内にあるSer298のリン酸化に着目した。リン酸化Ser298を特異的に認識する抗体を作製し、細胞周期G2/M期にSer298がリン酸化されることを明らかにした。Ser298がリン酸化されていないと、spacer、H3K9me3、LIG1K126me3のTTDへの結合は阻害されるが、Ser298のリン酸化によってその結合阻害が解除されることを生化学的に解明した。さらに、X線溶液散乱(SAXS)・分子動力学(MD)シミュレーション・熱安定性解析により、Ser298のリン酸化がlinker 2をTTDのpeptide-binding grooveから解離させ、その他の結合因子がpeptide-binding grooveに結合できるようになる分子機構を明らかにした。本研究により、リン酸化によるUHRF1の新たな構造-機能制御機構の一端を解明した。