[研究成果] 古関班と石黒班の領域内共同研究がDevelopment誌に掲載されました!
2021.05.17
Takada Y, Yaman-Deveci R, Shirakawa T, Sharif J, Tomizawa S, Miura F, Ito T, Ono M, Nakajima K, Koseki Y, Shiotani F, Ishiguro K, Ohbo K, Koseki H. Maintenance DNA methylation in pre-meiotic germ cells regulates meiotic prophase by facilitating homologous chromosome pairing. Development 148(10):dev194605. (2021) (古関班と石黒班の領域内共同研究)
精子形成におけるDNAメチル化の役割を解明〜NP95とDNMT1の減数分裂期における新機能〜
高田 幸 (熊本大学)、古関 明彦 (理研)
哺乳類の精巣では、精原細胞が分裂を繰り返し、自己再生と分化を繰り返しながら精子形成の根幹を担っている。精原細胞は、機能的な観点から、幹細胞としての能力を保持する未分化型精原細胞(As~Aal精原細胞)、そして前駆細胞としての分化型精原細胞(A1~A4、InおよびB型精原細胞)に大別される。
我々は以前、未分化型精原細胞でヘミメチル化DNA特異的結合タンパク質であるNp95を欠損させると、分化型精原細胞への移行で分化停止を起こし、DNAメチル化が幹細胞から前駆細胞への分化を制御していることを明らかにした(Shirakawa et al. Development 2013)。また、分化型精原細胞において、NP95は内在性レトロトランスポゾン(ERVs)を抑制することが明らかになっている(Dong et al. Nat Commun 2019)。しかし、減数分裂期において、DNAメチル化が相同染色体のペアリングや対合に関与しているのどうかは明らかになっていなかった。
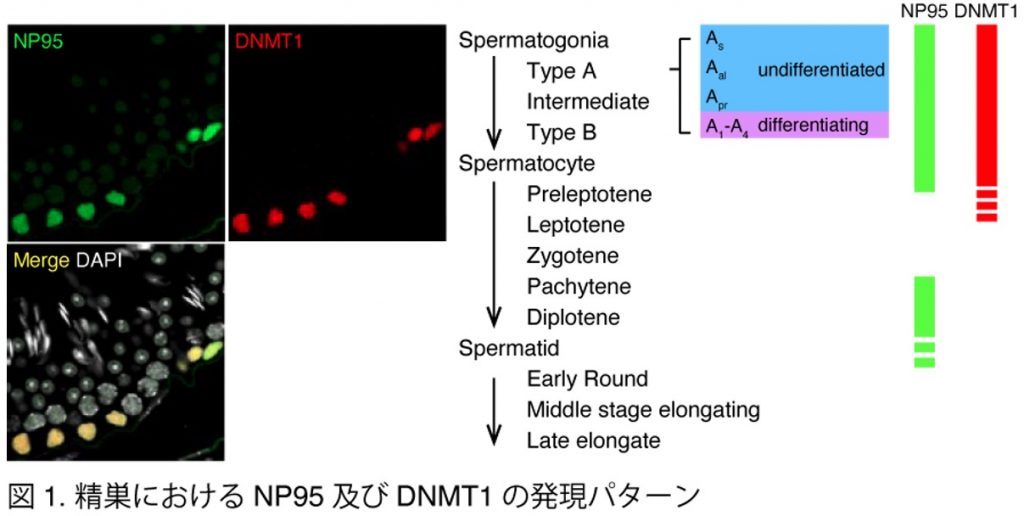
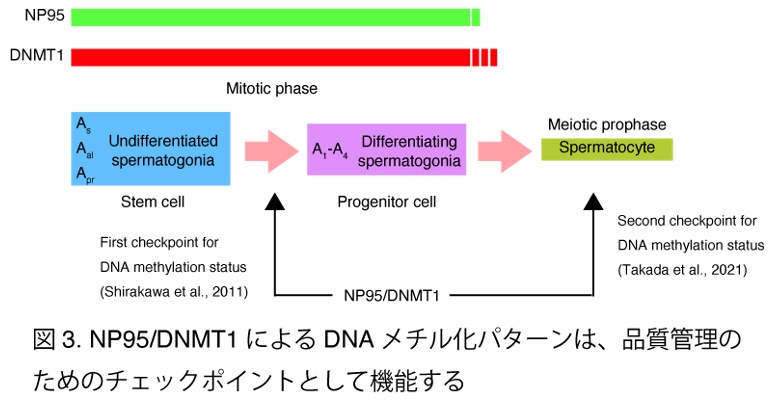
我々は、DNA維持メチル化がマウスの減数分裂期に寄与するメカニズムを明らかにすることを目的とした。まず、DNA維持メチル化にとって重要な2つの因子”NP95”と”DNMT1”がほぼ同時期に精原細胞内で共発現していることを明らかにした(図1)。さらに、Np95及びDnmt1を欠損させた精巣では、精母細胞が対合異常を起こし、精子形成不全となることが明らかとなった(図2)。減数分裂期前期の初期の精母細胞ではペリセントリックヘテロクロマチン(PCH)クラスターが形成されるが、これは染色体の空間的な動きを制御し、その後の相同染色体のペアリングを促進するために必要なプロセスである(Takada et al. Development 2011)。しかし、Np95及びDnmt1を欠失させた精母細胞ではPCHクラスタリングが起こっておらず、このため相同染色体のペアリングに失敗し対合異常を起こすことが示唆された。またPCH上での抑制的なヒストン修飾(H3K9me3及びH4K20me3)も減少していることがわかった。これらの結果から、NP95とDNMT1は、減数分裂期前期の初期において、PCH上のエピジェネティックな状態を適切に維持し、PCHクラスタリングに重要な役割を果たしていることが明らかになった。
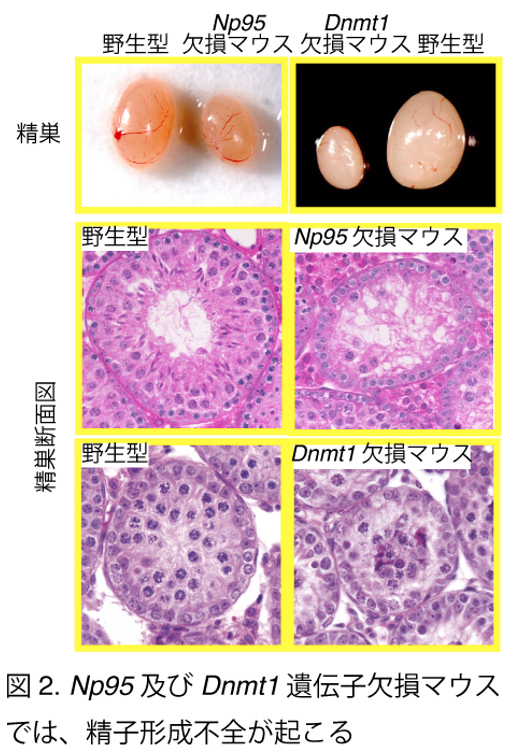
今回の結果やこれまでの知見は、精子形成過程においてDNAメチル化パターンが様々な品質管理機構によってチェックされていることを示唆している。分化型精原細胞でのNp95の欠失は減数分裂期前期において精子形成が停止する(Dong et al. Nat Commun 2019)。Dnmt3l変異体は、IAPの脱メチル化と脱抑制を起こしやはり精子形成が停止する(Bourc’his and Bestor. Nature 2004)。今回の研究では、維持DNAメチル化がH4K20me3やH3K9me3などの抑制的なヒストン修飾を維持し、減数分裂期初期のPCHクラスタリングを促進することも明らかになった。また、Np95を欠失させると、未分化型から分化型精原細胞への移行が阻害される(Shirakawa et al. Development 2013)。一方、NP95が抑制的なヒストンアルギニンメチル化を制御するPRMT5や、PIWIタンパク質と連携し、レトロトランスポゾンのサイレンシングを媒介していることも報告されている(Dong et al. Nat Commun 2019)。以上のことから、我々は、DNAメチル化マークは精子形成過程において複数の段階(未分化な精原細胞や、減数分裂期の精母細胞など)で、複数の経路によってモニターされていると予想している(図3)。