研究課題名
DNAメチル基転移酵素による新規メチル化標的領域の同定とその病態研究への応用
研究内容
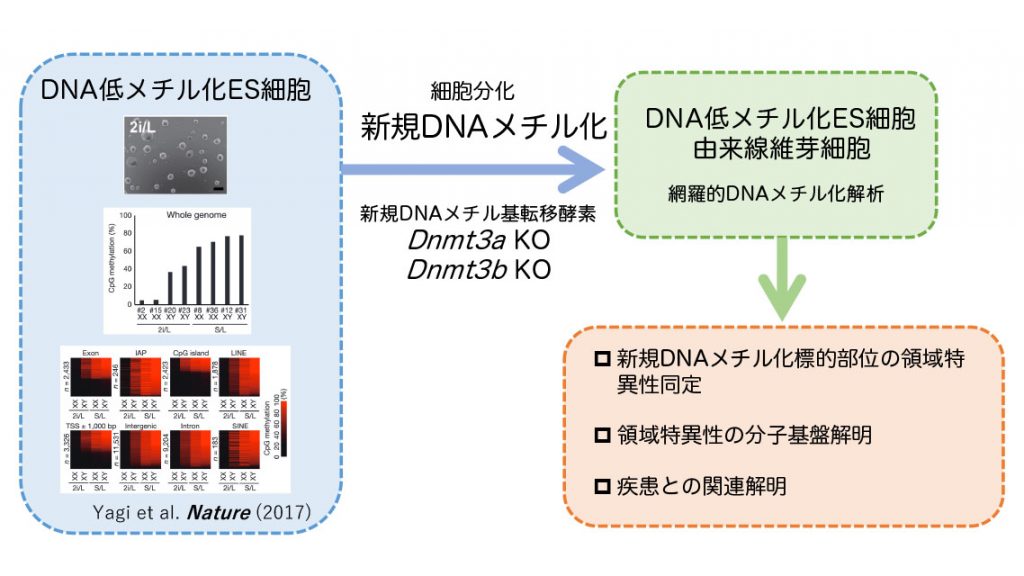
多様な形質を持つ多細胞生物の体細胞が、分裂の際に形質を維持しながら倍加するためには、非ゲノム情報も正確に複製される必要があります。なかでも抑制性非ゲノム情報の代表であるDNAメチル化はメチル基転移酵素によるDNAメチル化の維持および付加と受動的および能動的な脱メチル化のバランスによって維持され、体細胞形質の恒常性維持に重要な役割を果たしていることが示唆されています。実際に、DNAメチル化レベルの領域特異的な異常亢進は、がんをはじめとする様々な疾患で観察されています。しかしながら、DNAメチル化状態の複製機構破綻の原因については大部分が不明のままです。本研究では、DNAメチル化機構、なかでも新規DNAメチル基転移酵素DNMT3AおよびDNMT3Bに着目し、それぞれの酵素による新規DNAメチル化標的部位の領域特異性を明らかにするとともに、標的領域特異性を規定する分子基盤の解明を目指します。さらに、DNMT3AおよびDNMT3Bによる領域特異的DNAメチル化による遺伝子発現制御への関与を示し、その異常による個体発生異常や個体老化、がんなどの疾患発症機構の理解を目指します。最終的にはその分子機構に介入することで、効率的な細胞運命制御方法や疾患治療法の開発への応用を目指します。
主な論文
- Komura S, et al.,*Yamada Y. (21人中21番目). Cell-type dependent enhancer binding of the EWS/ATF1 fusion gene in clear cell sarcomas. Nature Commun 10(1):3999 (2019)
- Terada Y, et al.,*Yamada Y. (14人中14番目). Human pluripotent stem cell-derived tumor model uncovers the embryonic stem cell signature as a key driver in Atypical teratoid/Rhabdoid tumor. Cell Reports 26, 2608–2621 (2019)
- Shibata H, et al.,*Yamada Y. (15人中15番目). In vivo reprogramming drives Kras-induced cancer development. Nature Commun 9(1):2081 (2018)
- Yagi M, et al.,*Yamada Y. (9人中9番目). Derivation of ground-state female ES cells maintaining gamete-derived DNA methylation. Nature 548(7666):224-227 (2017)
- Ohnishi K, et al.,*Yamada Y. (15人中15番目). Premature termination of reprogramming in vivo leads to cancer development through altered epigenetic regulation. Cell 156(4):663-77 (2014)
