研究課題名
非コードRNAによって形成される核内相分離環境の継承機構の解明
研究内容
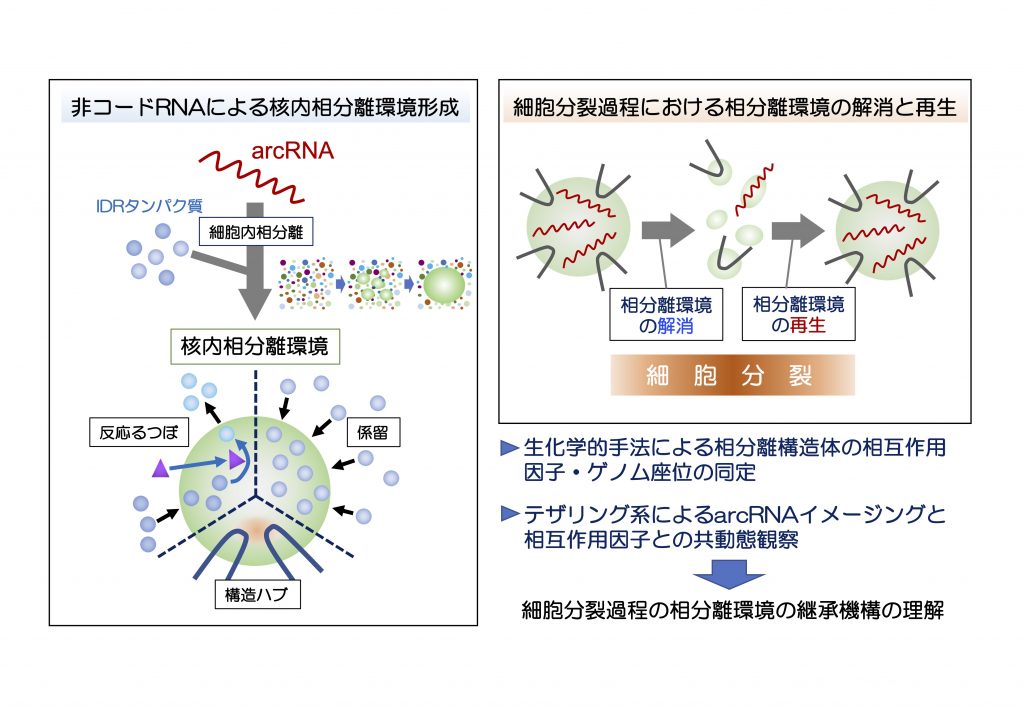
哺乳類細胞の核内には、膜を持たない構造体が複数存在し遺伝子発現の重要なハブとして働いていると考えられています。これまでに私たちは、特定の非膜性構造体の骨格として構造形成を先導する非コード RNAを発見し、Architectural RNA (arcRNA)と命名しました。arcRNA は特異的な天然変性タンパク質を集約して細胞内相分離を誘導して非膜性構造体を形成しており、その構造体は複数のクロマチン座位と相互作用して発現制御のハブとして働く可能性があります。このような相分離環境を介して形成されたクロマチン構造が、細胞分裂の過程でどのように継承されるのかについては、これまでほとんど知見がありません。そこで本研究では、私たちが長年研究してきたパラスペックルと核内ストレスボディという2種類の arcRNA 骨格をもつ非膜性構造体を取り上げ、構造体の構成因子および標的クロマチン座位との相互作用が、細胞分裂時にどのように解消され、さらに細胞分裂後に再形成されるのかを明らかにすることによって、相分離環境の継承メカニズムを解明することを目指します。そのために生化学的手法を用いた非膜性構造体の構成因子の変動検出、超解像イメージングと人為的テザリング系によるarcRNAの生細胞イメージングとクロマチン相互作用検出系を開発し、細胞分裂前後での相互作用をモニタリングすることを試行します。本研究によって相分離環境におけるエピジェネティック制御機構を明らかにすることで、当該領域の目指す非ゲノム情報の継承における新たな基盤知見の獲得が期待できます。
主な論文
- Yamazaki T, *Hirose T., et al., (3人中3番目) Architectural RNAs for membraneless nuclear body formation. Cold Spring Harb Symp Quant Biol. pii: 039404 (2020)
- Ninomiya K, *Hirose T., et al., (7人中7番目) LncRNA-dependent nuclear stress bodies promote intron retention through SR protein phosphorylation. EMBO J. 39: e102729 (2020)
- Yamazaki T, *Hirose T., et al., (10人中10番目) Functional domains of NEAT1 architectural lncRNA induce paraspeckle assembly through phase separation. Mol Cell 70: 1038-1053 (2018)
- Chujo T, *Hirose T., et al., (7人中7番目) Unusual semi-extractability as a hallmark of nuclear body-associated architectural noncoding RNAs. EMBO J 36: 1447-1462 (2017)
- Mannen T, *Hirose T., et al., (5人中5番目) The Sam68 nuclear body is composed of two RNase-sensitive substructures joined by the adaptor HNRNPL. J Cell Biol 214: 45-59 (2016)
