減数分裂における高次クロマチン構造の確立機構の解明
研究内容
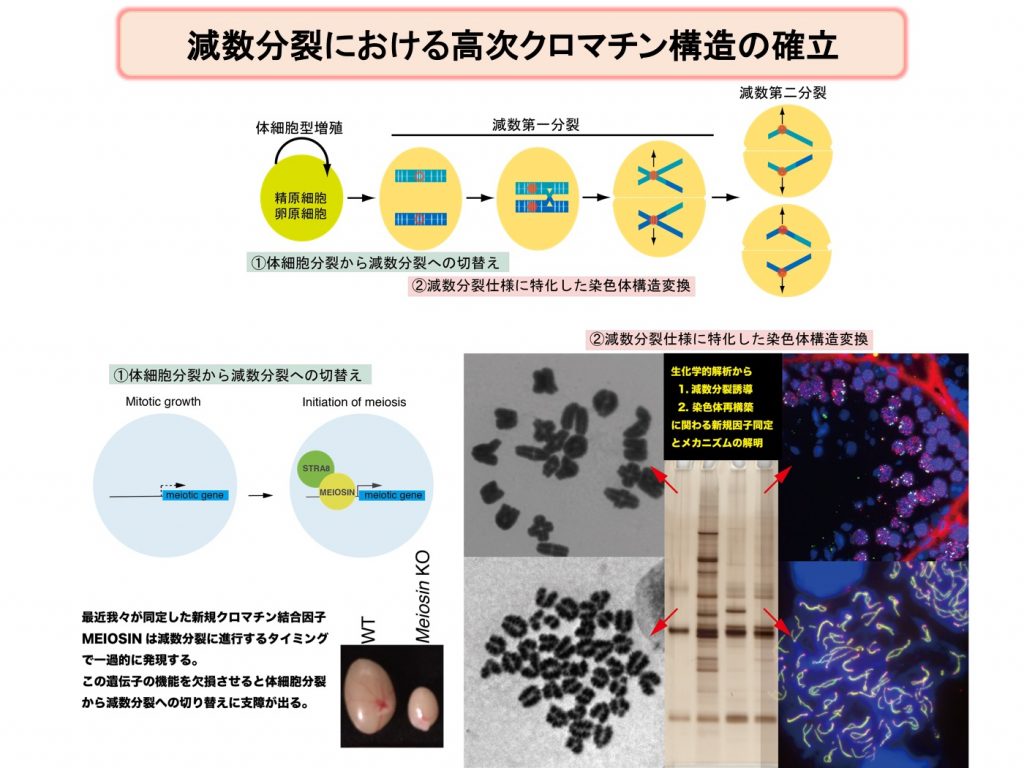
生殖細胞では通常の体細胞型細胞周期の機構を転用しながらも体細胞分裂から減数分裂への切り替えに伴って、減数分裂に特化されたクロマチン構造の再構築が起きている。DNAメチル化、ヒストン修飾、ヒストンバリアント置換、非ヒストンクロマチン結合タンパク質によって半保存的に非ゲノム情報複製を行う体細胞とは対照的に、この再構築は減数分裂直前のpre-meiotic S期にむしろその構造を解消するように働くと推定される。とりわけ減数第一分裂前期は細胞周期のG2期に相当するが、体細胞では見られないユニークな染色体動態が観察される。このときのクロマチン構造は減数分裂仕様に大幅に特殊化されていると推定されるが、その実態については未だ不明な点が多く国際的にも攻め倦んでいる。我々はこれまで、減数分裂期に特異的なクロマチン結合因子について研究を行ってきた。本研究では、次の2つの角度から検討を行い、生殖細胞系列と体細胞系列の非ゲノム情報複製に関わる様式の違いを本質的に決定付けるメカニズムの解明を目指す。
①pre-meiotic S期のクロマチン再構築を支えるメカニズムの解明
ごく最近、申請者が発見したMEIOSINによって発現制御を受ける未解析の標的遺伝子の中から、pre-meiotic S期において減数分裂仕様のクロマチン構造の再構築に役割を担う新規因子を同定し、生殖細胞系列と体細胞系列のクロマチン複製機構の違いや、減数分裂型の非ゲノム情報の伝達様式について検討を行う。
②体細胞分裂から減数分裂への遷移期の高次クロマチンドメインの解析
生殖細胞系列においては、体細胞型コヒーシンに置き換わって減数分裂型のコヒーシンが出現する。また生殖細胞型のインシュレーター因子の発現も見られる。体細胞増殖から減数分裂への遷移期における高次クロマチン構造の再構成過程について検討する。
主な論文
- Tanno N.et al., *Ishiguro K. (9人中9番目): FBXO47 is essential for preventing the synaptonemal complex from premature disassembly in mouse male meiosis. iScience 25(4), 104008 (2022)
- Tani N, Tanno N, *Ishiguro K. : Tandem immuno-purification of affinity-tagged proteins from mouse testis extracts for MS analysis. STAR Protocols 3 (2), 10145 (2022)
- *Ishiguro K. : Sexually dimorphic properties in meiotic chromosome. Sexual Development (2022) doi:1159/000520682
- *Ishiguro K. : Mechanism of initiation of meiosis in mouse germ cells Current Topics in Developmental Biology 151(2022)
- Hirano K.et al., Ishiguro K, Ogawa T, Yoshida S. (8人中5番目): Temperature sensitivity of DNA double-strand break repair underpins heat-induced meiotic failure in mouse spermatogenesis. Communications Biology 5, 504 (2022)
- Saito Y, Santosa V, Ishiguro K, Kanemaki M : MCMBP promotes the assembly of the MCM2–7 hetero-hexamer to ensure robust DNA replication in human cells. eLife 11, e77393 (2022)
- Kikuchi K.et al., Ishiguro K. (9人中5番目): Map7D2 and Map7D1 facilitate microtubule stabilization through distinct mechanisms to control cell motility and neurite outgrowth. Life Science Alliance 5 (8), e202201390 (2022)
- Oura S.et al., Ishiguro K, Ikawa M (10人中9番目): Trim41 is required to regulate chromosome axis protein dynamics and meiosis in male mice. PLOS Genetics 18(6): e1010241 (2022)
- *Ishiguro K., Shimada R. : MEIOSIN directs initiation of meiosis and subsequent meiotic prophase programs during spermatogenesis. Genes and Genetic Systems 96 (2021)
- Horisawa-Takada Y. et al., *Ishiguro K. (20人中20番目):Meiosis-specific ZFP541 repressor complex promotes developmental progression of meiotic prophase towards completion during mouse spermatogenesis. Nature Communications 12, 3184 (2021)
- Takada Y et al., Ishiguro K., Ohbo K, Koseki H. (14人中12番目): Maintenance DNA methylation in pre-meiotic germ cells regulates meiotic prophase by facilitating homologous chromosome pairing. Development 148(10):dev194605. (2021)
- Oura S et al., Ishiguro K., Ikawa M. (7人中6番目): KCTD19 and its associated protein ZFP541 are independently essential for meiosis in male mice. PLOS Genetics 17(5): e1009412 (2021)
- Imai Y et al., Ishiguro K., Sakai N. (7人中6番目):Sycp1 is not required for subtelomeric DNA double-strand breaks but is required for homologous alignment in zebrafish spermatocytes. Front. Cell Dev. Biol. 9, 664377 (2021)
- Fujiwara Y.et al., *Ishiguro K. (12人中12番目): Meiotic cohesins mediate initial loading of HORMAD1 to the chromosomes and coordinate SC formation during meiotic prophase. PLOS Genetics16(9): e1009048. (2020)
- Tanno N.et al., *Ishiguro K. (10人中10番目): Phosphorylation of the Anaphase Promoting Complex activator CDH1/FZR regulates the transition from Meiosis I to Meiosis II in mouse male germ cell. Scientific Reports 10, 10094 (2020)
- Takemoto K.et al., *Ishiguro K. (10人中10番目): Meiosis-specific C19orf57/4930432K21Rik/ BRME1 modulates localization of RAD51 and DMC1 to DSBs in mouse meiotic recombination. Cell Reports 31, 107686 (2020)
- Ishiguro K.et al. (13人中1番目): MEIOSIN directs the switch from mitosis to meiosis in mammalian germ cells. Dev. Cell 52(4), 429-445 (2020)
- Takemoto K.et al., Ishiguro K, Sakai N. (7人中6番目): Sycp2 is essential for synaptonemal complex assembly, early meiotic recombination and homologous pairing in zebrafish spermatocytes. PLOS Genetics 16(2) e1008640 (2020)
- Nakatake Y. .et al. (27人中19番目): Generation and profiling of 2,125 transgenic human ESC lines for the systematic analyses of cell states perturbed by inducing single transcription factors: Cell Reports 31, 107655 (2020)
