[研究成果] 村上班の研究成果がNucleiuc Acids Research誌に掲載されました!
2022.10.22
Tsunemine S, Nakagawa H, Suzuki Y, Murakami Y. The chromatin remodeler RSC prevents ectopic CENP-A propagation into pericentromeric heterochromatin at the chromatin boundary. Nucleic Acids Research. 50 (19): 10914–10928 (2022)
遺伝情報継承に重要な染色体領域を維持する仕組みを解明
~がん化プロセスの理解やその治療への貢献に期待~
真核生物のDNAはヒストンたんぱく質複合体にDNAが巻きついた“ヌクレオソーム”を単位とするクロマチン構造を作り核内に収納されています。セントロメアは、有糸分裂期に形成され、紡錘糸と結合するキネトコアの基盤となる重要なクロマチンドメインです。ほとんどの真核生物のセントロメアは、ヒストンH3のセントロメア特異的なバリアントであるCENP-Aで規定されるCENP-Aクロマチンと凝縮した構造を持つヘテロクロマチンの2つの異なるクロマチン構造から構成されています。この境界は厳密にその場所が決まっており、これが正しく制御されていないと、キネトコアが機能不全を引き起こし、染色体分配の異常が起きます。しかし、CENP-Aクロマチンとヘテロクロマチンの境界を規定するメカニズムはほとんど明らかではありません。
クロマチンリモデラーは、ヌクレオソームを形成する、解体する、動かすなどの機能を持ち、クロマチン関連の多くのプロセスで重要な役割を果たしています。私たちはクロマチン研究の優れたモデル系である分裂酵母を用いた先行研究により、クロマチンリモデラーの1つRSC(Remodeling the Structure of Chromatin)の必須サブユニットであるSfh1の変異株では染色体の安定性が低下することを観察しており1、RSCがセントロメアで機能することを予想していましたがその詳細は不明でした。そこで本研究では、RSCがセントロメアにおいて担う機能の解明を目的としました。
遺伝学的・生化学的な解析からRSCはヘテロクロマチンよりCENP-A(分裂酵母ホモログCnp1)クロマチンを制御していることが示唆されたので、sfh1変異株におけるCENP-ACnp1の分布を確認しました。すると、セントロメア領域内でCENP-ACnp1の局在領域がヘテロクロマチン領域に異常拡張していることが観察されました。CENP-ACnp1の異常な局在はテロメアや分裂酵母の性決定領域のヘテロクロマチンでは観察されないので、この異常局在はセントロメア内のCENP-ACnp1クロマチンとヘテロクロマチンの境界機能が損なわれCENP-ACnp1の異常拡張が起こった事を示しています。
CENP-ACnp1の異常拡張は、キネトコアを構成するタンパク質を本来これが局在しないヘテロクロマチン領域に集積させており、このキネトコア領域の拡大が染色体分配の異常の原因であると考えられました。転写が不活性なヘテロクロマチンではヒストンのアセチル化修飾レベルは低くたもたれていますが、sfh1変異株のヘテロクロマチン領域におけるヒストンアセチル化レベルを人為的に上昇させると、CENP-ACnp1の異常拡張が解消し、その結果として染色体分配異常が部分的に回復することが確認されました。この結果は、sfh1変異株の染色体分配異常は、セントロメアにおけるCENP-ACnp1の異常分布に起因することを示すとともにヘテロクロマチンへのCENP-ACnp1の拡張にはヒストンのアセチル化レベルが低いことが必要であることを示しています。
更なる解析の結果、RSCは境界領域でCENP-ACnp1を排除してヌクレオソーム欠失領域(NDR, Nucleosome-Depleted Region)の形成を誘導していることが明らかになりました。境界領域にはtRNA遺伝子が複数個存在し、tRNA転写に関わるTFIIIC(Transcription Factor IIIC)がNDRを形成しヘテロクロマチンのCENP-Aクロマチンの拡張を阻止していることが知られています。私達は上記RSCによるNDR形成機構は、TFIIIC依存的NDR形成機構とは独立して機能していることを示しました。つまり、前者がCENP-Aを後者がヒストンH3を境界領域から排除することでセントロメアクロマチンの境界を維持していることになります。また、転写活性遺伝子をsfh1変異株の境界領域に挿入することで、CENP-ACnp1の異常拡張が挿入部位外部のヘテロクロマチンで特異的に解消することを示しました。転写反応は活発なヒストンの交換や局所的な染色体の脱凝集を促進することで空間的なギャップを形成すると考えられており、野生株の境界領域ではRSCがそれと同様な役割を担っていることが示唆されました。
以上の結果は、未知であったCENP-Aドメインの境界決定機構を初めて明らかにしたものであり、他のクロマチンドメインの分布やその大きさを制御するメカニズム、特にその制御におけるクロマチンリモデラーの機能を考える上で一つの洞察をあたえるものです。
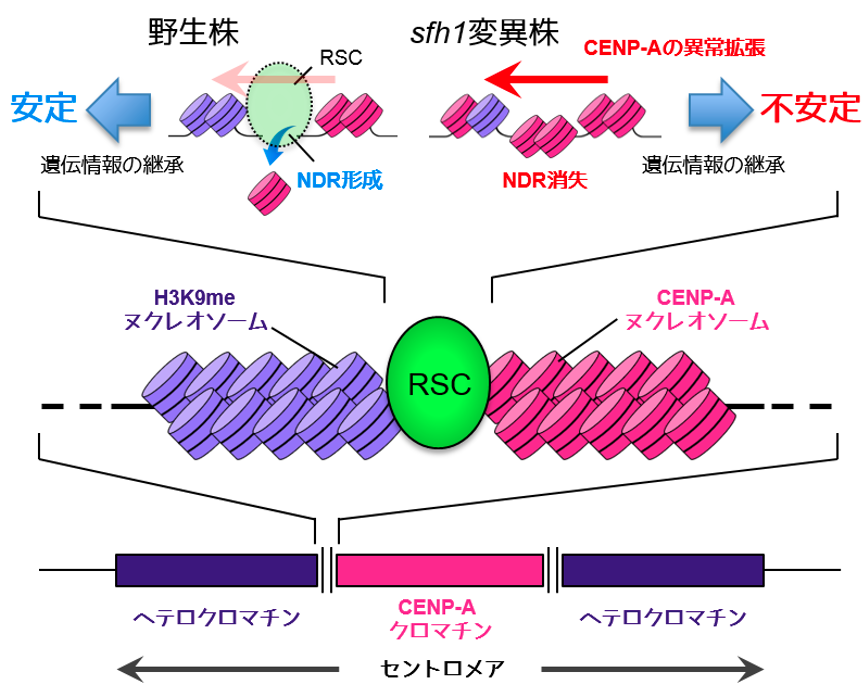
図 RSCによる異所的CENP-A侵入に対するバリア機構と遺伝情報継承との関係