[研究成果] 村上班と油谷班の共同研究がGenes Dev誌に掲載されました!
2022.12.28
Asanuma T, Inagaki S, Kakutani T, Aburatani H, Murakami Y. Tandemly repeated genes promote RNAi-mediated heterochromatin formation via an antisilencing factor, Epe1, in fission yeast. Genes and Development in press
繰り返し配列のDNAがヘテロクロマチン化される仕組みを解明
~40年来の謎に答える新しいモデルを提唱~
真核生物のクロマチン構造は、ユークロマチンとヘテロクロマチンに大別されることが知られています。ユークロマチンではDNA上の遺伝子は活発に発現する一方、ヘテロクロマチンでは遺伝子の発現が強制的に抑制されます。この対照的な2つの状態はDNAが巻き付くヒストンの化学修飾によって決まっており、例えばヘテロクロマチンの場合、ヒストンH3の9番目のリジンのメチル化修飾(H3K9me修飾)によって特徴づけられます。真核細胞はH3K9me修飾酵素(writer) とその修飾を除去する酵素(eraser)の両方を持っており、ヒストン修飾を変化させることで、クロマチン状態の制御を行なっていると考えられています。このようなクロマチンの状態を介した遺伝子の発現制御は真核細胞が持つ根本的な仕組みの1つであり、様々な生命現象に関与しています。
興味深いことに、ヘテロクロマチンは繰り返し配列になったDNA領域において形成される傾向があることが現在までの研究で明らかになってきています。この繰り返し配列には、特定の塩基配列を基本単位とする繰り返しDNA配列以外に、遺伝子全体が重複して繰り返しになった場合も含まれます。これらの事実は、真核細胞はDNA配列が“繰り返しになっている”という特徴を認識し、その領域におけるヘテロクロマチン形成を何らかの方法で促進しているということ示唆しています。しかし、そのメカニズムは未だ明らかになっていません。
繰り返し配列におけるヘテロクロマチン形成を代表する最も有名な例が、セントロメア近傍領域におけるヘテロクロマチン形成です。セントロメア近傍のヘテロクロマチン領域におけるDNA配列はそれぞれの種特異的な繰り返し配列で構成されている一方で、多くの種で共通してヘテロクロマチンが形成されています。そこで研究グループは今回、モデル生物である分裂酵母を用いて、何故その染色体のセントロメア近傍領域が選択的にヘテロクロマチン化されているのか、という解析から研究に着手しました。
分裂酵母の染色体におけるセントロメア近傍のヘテロクロマチン領域は単純な繰り返しDNA配列ではなく、dg/dh と呼ばれる特定の塩基配列で構成されています。このdg/dhからはnon-coding RNA(ncRNA)が転写されており、それがRNAiという経路の標的になることでヘテロクロマチン形成が誘導されることが現在までの研究で明らかになっています。RNAi経路は、二十数塩基のsmall RNAと、そのsmall RNAを介してそれと相補的な配列を持つ標的RNAを認識するArgonaute蛋白質を中心に構成されています。現在では、Argonaute蛋白質がsmall RNAを介してdg/dh ncRNAを認識する際に、H3K9me修飾酵素をクロマチン近傍にリクルートすることでヘテロクロマチン形成が促進されると考えられています [図1]。ところが興味深いことに、人工的なsmall RNAを細胞内で産生することで、RNAi経路にユークロマチン領域にあるmRNA遺伝子を人為的に認識させても、効率的なヘテロクロマチン形成は誘導されないということが近年の研究で分かってきました。この結果は、dg/dh ncRNAが通常のmRNAにはない、RNAi経路依存的ヘテロクロマチン形成に重要な特性を持っていることを意味していましたが、その実体は未だ明らかになっていませんでした。
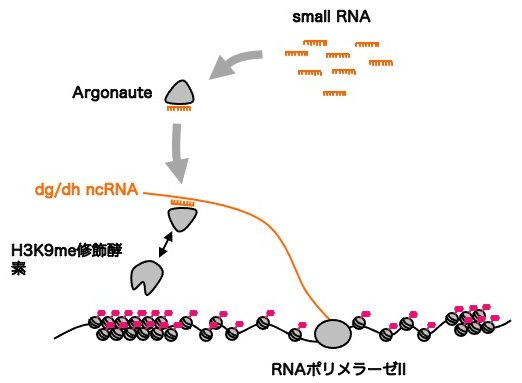
図1. RNAi経路依存的ヘテロクロマチン形成機構のモデル図。
dg/dh ncRNAの特性を調べる研究がこれまであまり進んでこなかった理由の1つとして、dg/dh ncRNAの発現は通常ヘテロクロマチン形成により抑制されているため、その検出や解析自体が難しかったということが挙げられます。そこで今回研究グループは、H3K9me修飾を除去する蛋白質であるEpe1という因子に着目しました。研究グループはまず、このEpe1を細胞内で過剰発現すると、dg/dh ncRNAの発現量が30倍近く増加し、それと同時にRNAi経路が高活性化状態になることを見いだしました。次に研究グループはこの時dg/dh ncRNAの発現量が増加することに着目し、その状況を利用してdg/dh ncRNAの詳細な解析を行ないました。その結果、本来サイレントなヘテロクロマチンが形成されるdg/dh配列には実は沢山の転写開始点が存在しているということが明らかになりました[図2]。
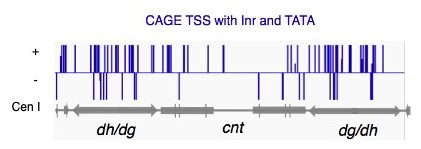
図2. Epe1過剰発現条件下で行なったCAGE解析を行い、dg/dh ncRNAの転写開始点(TSS)を検出した結果。dg/dh配列中にはmRNA遺伝子と同じInrとTATAを持つタイプの転写開始点が遍在していた。
そこで研究グループはこのように転写開始点が沢山あることが、転写が抑制されているヘテロクロマチンにおいてもRNAi経路の認識に必要な標的RNAを十分量供給することを可能にするのではないか、と考えました。そしてもしもこの仮説が正しければ、通常のmRNA遺伝子でも、ゲノム上の一カ所で繰り返しにした状態にすれば、dg/dh配列同様、ヘテロクロマチン存在下で十分量の標的RNAを供給することが出来、効率よくヘテロクロマチン形成を誘導できるのではないか、と考えました。そこで研究グループはある特定のmRNA遺伝子が最大8回繰り替えした状態で染色体の一カ所に存在する細胞を作成し、その解析を行ないました[図3]。まず、mRNA遺伝子を繰り返しただけでは自発的なヘテロクロマチン形成は起きませんでした。次に、人工的なsmall RNAによってRNAi経路を介したヘテロクロマチン形成を誘導してみたところ、繰り返しになった標的遺伝子を持つ細胞では繰り返しを持たない細胞と比べて50倍近い効率でヘテロクロマチンが形成されました。解析の結果、繰り返しになった標的遺伝子上ではRNAi経路がsmall RNAを効率的に“再生産”することが出来、その結果ヘテロクロマチン形成が促進されていることが分かりました。注目すべきことに、一度“再生産”が始まると、最初誘導に用いたsmall RNAが細胞から取除かれた後も、RNAi経路は自律的に活性化し続け、その領域のヘテロクロマチンを維持するようになっていました。この結果は、これまでdg/dh 配列で解析されてきたRNAiを介したヘテロクロマチン形成が、通常のmRNA遺伝子を繰り返しに配置することによっても人為的に再現できることを示しており、研究グループはこれをrepeat-induced RNAiと名付けました。
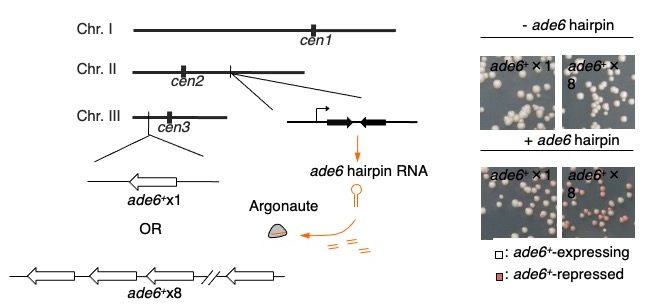
図3. 繰り返しにしたmRNA遺伝子(ade6+)にRNAiを介したヘテロクロマチン形成を人為的に誘導する系の模式図。
このrepeat-induced RNAiの系を用いて、次に研究グループはEpe1とRNAiの関係を調べました。その結果、Epe1はヘテロクロマチン下にある標的遺伝子を脱抑制することで、RNAi経路に必要な標的RNAを供給しており、この時RNAi経路が活性化されるかどうかは、標的遺伝子の繰り返しの数に依存しているということが明らかになりました。標的遺伝子が一定数以上繰り返しになっている場合、Epe1によって十分量の標的RNAが供給されるため、RNAi経路はsmall RNAを再生産することで自律的に活性化し、ヘテロクロマチンは維持されます。一方で繰り返しの数が不十分な場合、Epe1によって供給される標的RNAが少ないためRNAi経路は活性化されず、その結果Epe1による脱抑制はヘテロクロマチンの除去という逆の結果を招きました。つまりEpe1は、繰り返しの状態に応じて「ヘテロクロマチン形成の促進」と「ヘテロクロマチンの除去」という相反する2つの役割を果たしていたのです[図4]。
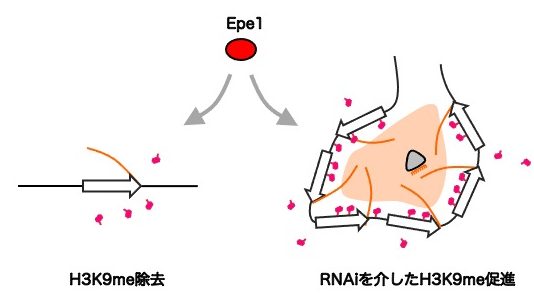
図4. H3K9me除去因子であるEpe1は相反する2つの役割を持つ。
これまで繰り返しDNA配列におけるヘテロクロマチン形成については、繰り返しになっていること自体が DNA-DNA相互作用、異常な転写産物、遺伝子量の閾値の超過といった異常の原因になり、それが細胞に認識されることでヘテロクロマチン形成が起きると考えられてきました。今回示したrepeat-induced RNAiは繰り返しになったmRNA遺伝子に基づいていますが、dg/dh ncRNAのような変化形が存在することを考えると、転写さえ起きるのであれば、もっと単純な繰り返しDNA配列においても同様の仕組みが機能しうると予想されます。「ヘテロクロマチンを除去する因子が繰り返し配列と組み合わさるとRNAiを介して逆にヘテロクロマチン形成を促進する」という今回の結果は、なぜ真核細胞において繰り返しDNA配列で選択的にヘテロクロマチン形成が促進されているのか、という問いに新たな洞察を与えるものです。