[研究成果] 有田班と中西班の共同研究がNucleic Acids Res誌に掲載されました!
2022.11.26
Hata K., Kobayashi N., Sugimura K., Qin W., Haxholli D., Chiba Y., Yoshimi S., Hayashi G., Onoda H., Ikegami T., Mulholland CB., Nishiyama A., Nakanishi M., Leonhardt H., Konuma T., Arita K. Structural basis for the unique multifaceted interaction of DPPA3 with the UHRF1 PHD finger. Nucleic Acids Res. 2022. DOI: 10.1093/nar/gkac1082
「母性因子DPPA3によるUHRF1の機能阻害の構造基盤」
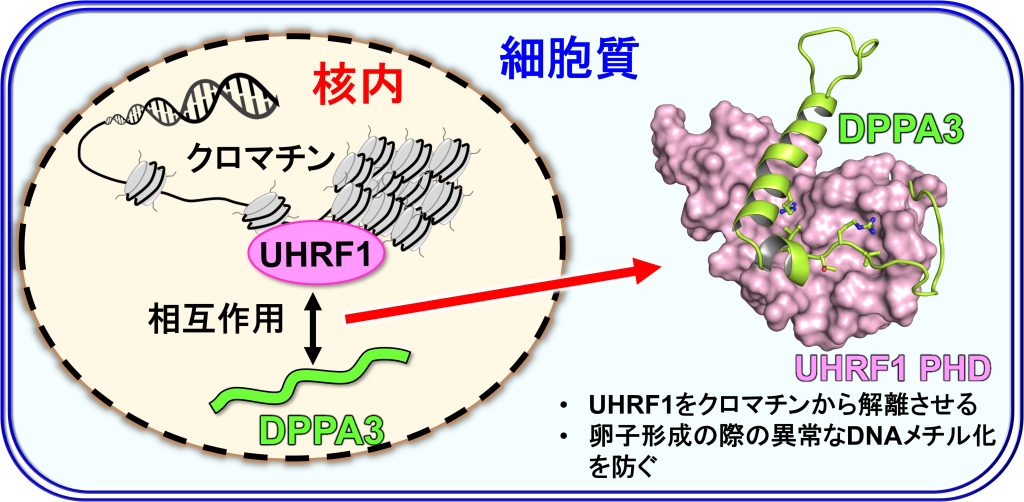
卵子形成において、母性因子DPPA3(Developmental Pluripotency Associated 3, 別名Stella, PGC7)は、維持メチル化因子UHRF1のクロマチン局在を阻害し、UHRF1を核外に局在させます(Li et al., Nature 2018)。これにより、UHRF1を介したDNMT1による過剰なDNAメチル化が阻害されこれが正常な卵子形成に必須です。DPPA3によるUHRF1のクロマチン結合阻害の分子機構を解明するためにDPPA3とUHRF1の複合体の構造解析を行いました。
UHRF1はアミノ末端からUBL, TTD, PHD, SRA, RINGの5つのドメインから構成されます。一方でマウスDPPA3は150アミノ酸残基からなる天然変性タンパク質です。まず、UHRF1とDPPA3の複合体形成に必要な領域を検討した結果、UHRF1のPHDドメインとDPPA3のC末端領域の76-127アミノ酸残基を結合領域として同定しました。
これらの領域から成るUHRF1 PHDとDPPA3の複合体構造を溶液NMR法で決定しました。UHRF1 PHDはpre-PHDとcore-PHDの2つの領域から成る構造をしています。UHRF1 PHDの結合に伴ってDPPA3に特徴的な構造誘起が起こることがわかりました。DPPA3は中央領域で短いαヘリックス構造を形成し、その直後に‘’L字’の形をとるように約90度曲がり、長いαヘリックスを形成していました。この長いαヘリックスが、pre-PHDとcore-PHDの間の溝に入り込んでUHRF1 PHDと結合していました。これまでの研究から、UHRF1 PHDはヒストンH3のアミノ末端のART配列や、PAF15のアミノ末端のVRT配列と結合することが知られていました。一方でDPPA3は、88-90番目でVRT配列を持ちます。つまりDPPA3は既存の結合モチーフに加えて、短いαヘリックスと長いαヘリックスも使ってUHRF1 PHDと相互作用することになります。この広い相互作用面によって、DPPA3はUHRF1 PHDにヒストンH3やPAF15よりも70倍も強い親和性で結合することがわかり、これによりUHRF1をクロマチンから引き剥がすことがわかりました。
さらに相互作用面に位置するアミノ酸残基に変異を導入した変異体DPPA3を作成して、アフリカツメガエルの卵抽出液やマウスES細胞を用いた解析を行いました(東京大学 中西真 教授、西山敦哉 准教授、ミュンヘン大学 Heinrich Leonhardt教授との共同研究)。まず、UHRF1 PHDとの相互作用面に存在するDPPA3のVRT配列、短いα-ヘリックスや長いα-ヘリックス中のアミノ酸残基に変異を導入したDPPA3は、UHRF1 PHDとの結合が弱くなる、または消失することを生化学的に確認しました。次に、ツメガエル抽出液を用いた実験から、これら変異体DPPA3はUHRF1のクロマチンへの局在を抑制できないことがわかりました。最後にツメガエル抽出液とマウスES細胞を用いてDNAメチル化解析を行いました。野生型DPPA3はUHRF1をクロマチンから解離させるので、ゲノムDNAの脱メチル化が起こります。しかし、変異体DPPA3ではDNAの脱メチル化を起こせないことがわかりました。これらのことから、構造生物学的に同定したUHRF1とDPPA3の相互作用が、細胞内におけるUHRF1の機能阻害(クロマチン局在の阻害)に必須であることがわかりました。