[研究成果] 松﨑班の研究がCommunicatoions Biology誌に掲載されました!
2021.12.21
Matsuzaki H, Miyajima Y, Fukamizu A, Tanimoto K. Orientation of mouse H19 ICR affects imprinted H19 gene expression through promoter methylation-dependent and -independent mechanisms. Commun Biol, 4(1): 1410 (2021)
ゲノム刷り込みが正しく調節される仕組みを解明
〜発現調節DNA配列の方向にも重要な意味がある〜
概要
私たちヒトを含む哺乳動物は、有性生殖によってゲノム(全遺伝情報)を両親から1セットずつ、計2セット受け継ぎます。そして、父母それぞれに由来する遺伝子のほとんどは、子において等しく働き(発現し)ます。ところがごく一部の遺伝子は、父親由来、母親由来のどちらか決まった一方しか発現しません。この現象を「ゲノム刷り込み(ゲノムインプリンティング)」と呼びます。ゲノム刷り込みは哺乳動物の正常な発生・成長に重要で、破綻するとヒトの疾患の原因にもなります。
本研究グループは、ゲノム刷り込みを受けるH19遺伝子が、父親由来では抑制され、母親由来のみで正しく発現するメカニズムを解析しました。具体的には、ゲノム編集技術を使い、H19遺伝子の発現調節領域(H19-ICR)のDNA配列を反転させたマウスを作製し、その働きを調べました。
その結果、父親由来では、H19-ICRのDNA配列が正しい方向で配置されていることで、H19遺伝子の転写開始に必要なDNA領域が高度にメチル化され、これがH19遺伝子の完全な発現抑制に必要であることが分かりました。一方、母親由来では、H19-ICR配列の方向はメチル化には影響しないが、正しい方向に配置されていないと、H19遺伝子の発現が低下することが明らかになりました。
本成果は、H19-ICR配列が父親由来と母親由来で異なる作用を持つことで、H19遺伝子の発現量が調節されていることを示しています。シルバーラッセル症候群やベックウィズ−ヴィーデマン症候群など同遺伝子座の制御の破綻が原因とされる疾患の理解に貢献できることが期待されます。
研究の背景
私たちヒトを含む哺乳動物は、有性生殖によりゲノム(遺伝情報)を父親と母親から1セットずつ、計2セット受け継ぎます。その遺伝子のほとんどは、両親由来の二つともが子供において等しく発現して働きます。ところが、ごく一部の遺伝子(ヒトやマウスでは約150個)は、両親から全く同じDNA配列を受け継いでいても、決まった一方の親由来のものしか発現しません。あたかも、父と母のどちら由来かが遺伝子に記憶されて(刷り込まれて)いるように見えるため、この現象は「ゲノム刷り込み(ゲノムインプリンティング)」と呼ばれています。ゲノム刷り込みがあるために、哺乳動物の正常発生には両親由来の2セットのゲノムがそろうことが必要である(単為発生が起こらない)と考えられています。また、この制御の破綻が、発育遅延を示すシルバーラッセル症候群や過成長を示すベックウィズ−ヴィーデマン症候群などヒト疾患の原因になることも知られています。このため、片方の親に由来する遺伝子のみが正しく発現するメカニズムを明らかにすることは重要です。
研究の内容と成果
本研究グループは、ゲノム刷り込みを受ける遺伝子の一つであるH19遺伝子が、父親由来では抑制され、母親由来のみで正しく発現するメカニズムを解析しました(参考図)。H19遺伝子上流にある発現調節領域(H19-ICR)が、父親由来の時にのみDNAメチル化注1)されることが関係することは、既に知られていました。しかし、それが実際にどのようにH19遺伝子の転写を調節するかについては分かっていませんでした。
本グループの先行研究において、父親由来の高メチル化されたH19-ICRのDNA配列の方向が、下流のH19遺伝子の抑制に重要であると予想される結果が得られていました。そこで、ゲノム編集技術注2)を使ってH19-ICR配列の方向をマウス個体内で反転させて、検証を行いました。その結果、父親由来の染色体のH19-ICRを反転させると、H19プロモーター注3)のDNAメチル化が低下し、それと同時に、本来抑制されているはずのH19遺伝子が発現するようになりました。従って、H19-ICRが方向依存的にH19プロモーターをメチル化することが、H19遺伝子の転写を完全に抑制するために必要であると考えられました。
一方で、母親由来の染色体でH19-ICR配列を反転させると、H19プロモーターは低メチル化状態のままだったにも関わらず、H19遺伝子の発現量が低下しました。つまり、母親由来では、H19-ICR配列の方向はプロモーターのメチル化には影響しないが、H19遺伝子の発現を活性化するために重要であることが明らかになりました。これらの結果から、H19-ICR配列が父親由来と母親由来でそれぞれ異なる作用を持つことにより、H19遺伝子の発現が調節されていることが示唆されました。
今後の展開
本研究結果により、H19-ICR配列の方向がH19遺伝子のゲノム刷り込み発現に与える効果が明らかになりました。今後は、このH19-ICRの機能の根本にある、H19-ICR自体が父親由来の時にのみDNAメチル化される仕組みについて解析を進める予定です。
参考図
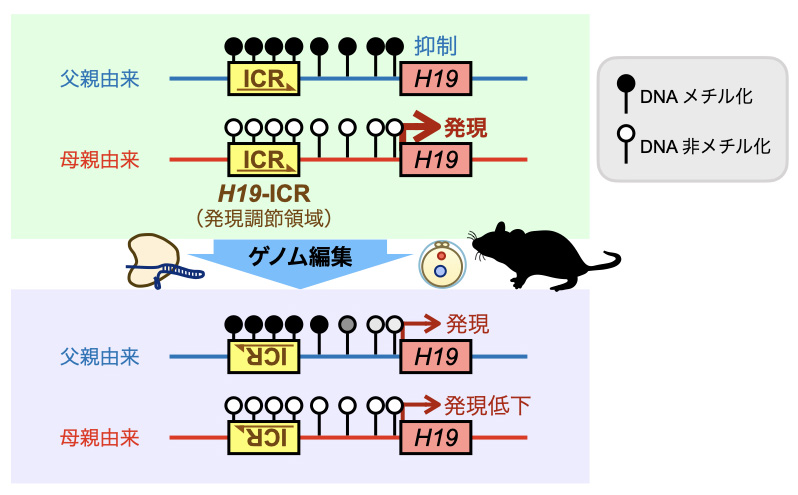
図 ゲノム編集技術によるH19遺伝子発現調節機構の解析
ゲノム編集技術によって、発現調節領域(H19-ICR)配列をマウス個体内で反転させたところ、同配列が、父親由来と母親由来でそれぞれ異なる作用を持って、H19遺伝子の発現を調節していることが分かりました。
用語解説
注1)DNAメチル化:メチル基の付加によりDNAの一部が化学修飾されること。哺乳動物細胞では、ゲノムDNAのCpG配列(シトシンとグアニンが連続する配列)のシトシンがメチル化されることが多い。
注2)ゲノム編集技術:ゲノム上の任意の標的DNA配列の改変を可能にする技術。本研究では、CRISPR/Cas9システムを用いた。
注3)プロモーター:転写因子複合体やRNAポリメラーゼが結合して転写の開始を制御する、遺伝子の転写開始点付近の領域。