白血病の非ゲノム複製機構に着目した新規治療標的の探索
研究内容
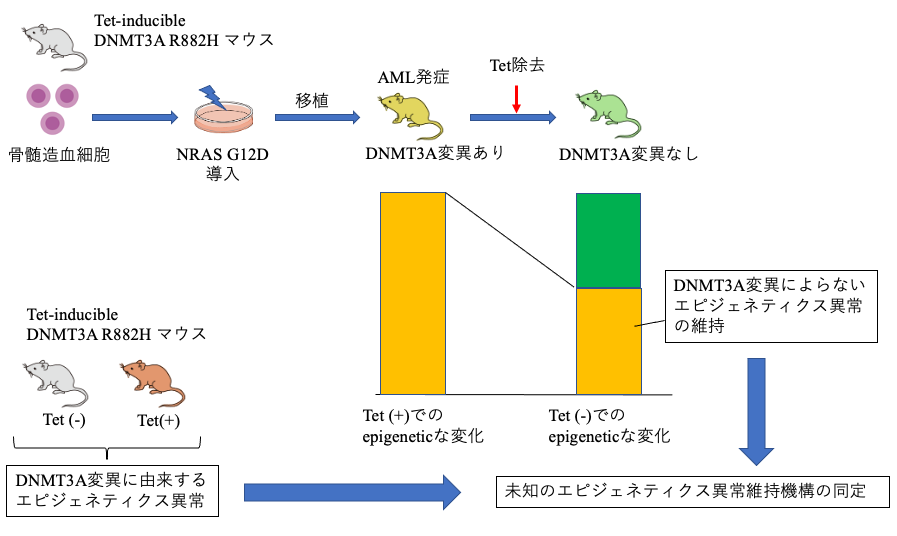
急性骨髄性白血病(acute myeloid leukemia; AML)はさまざまな遺伝子変異が病態に寄与することが知られている。近年、AMLでみられる遺伝子異常によるクローン性造血がAML発症以前に生じており、とくにエピジェネティクス修飾にかかわるDNMT3A, ASXL1, TET2遺伝子などの異常がこのクローン性造血において高頻度に見られることが明らかになった。なかでもDNMT3A変異は全体の半数近くを占める。このような疫学的な知見の集積にもかかわらず、DNMT3A変異がAMLの病態形成において果たす役割や治療標的としてのDNMT3Aの意義に関しては不明な点が多い。DNMT3A変異は一般に単独では白血病原性が十分でなく、AML発症には付加的なドライバー遺伝子異常を必要とするが、DNMT3A変異が生み出す多様なエピジェネティック異常のうち、どれが発症後のAMLの維持や進展に必要かは明らかではない。DNMT3A変異によって生じたエピジェネティクス異常のうち、DNMT3Aを正常化しても、付加的遺伝子異常の存在下で非ゲノム複製機構により保持されるエピジェネティクス修飾が存在する可能性があり、このような異常こそ、DNMT3A変異陽性AMLの病態形成に重要な役割を果たすと推測できる。
本研究では、DNMT3A変異により生じたエピジェネティックな変化が、発症後のAMLにおいてはDNMT3Aによらない未知の機構により強固に維持され、AMLの維持に決定的な役割を果たしているという仮定のもと、その標的となっている遺伝子群を探索し、最終的にはDNMT3A変異陽性AMLにおいて特異性が高い治療標的を新規に同定することを目的とする。具体的には、テトラサイクリン誘導性に変異型DNMT3Aを発現するトランスジェニックマウスの骨髄細胞にNRAS G12Dなどの付加的な白血病遺伝子を導入し、AML発症後に変異型DNMT3AをサイレンスしたときのAMLの状態を解析する。DNMT3A変異によって生じたエピジェネティクス異常のうち、AMLにおいてDNMT3A変異を消失させても不可逆的である異常を同定する。その異常の標的となっている遺伝子の発現や遺伝子産物の活性を制御する手法を開発し、DNMT3A変異陽性AMLに対する新たな治療法の基盤を創出する。このように、本研究においてエピジェネティクス異常を維持する未知の機構を同定することにより、DNMT3A変異陽性AMLの病態解明に寄与するだけでなく、非ゲノム複製機構と疾患の関連性を明らかにし、新しい視点にもとづく治療の実現に近づくことが期待される。
主な論文
- Miyauchi M, et al., Kurokawa M. (12人中12番目) Efficient production of human neutrophils from iPSCs that prevent murine lethal infection with immune cell recruitment. Blood 138, 2555 (2021)
- Uni M, et al., Kurokawa M. (7人中7番目) Modeling ASXL1 mutation revealed impaired hematopoiesis caused by derepression of p16Ink4a through aberrant PRC1-mediated histone modification. Leukemia 33, 191 (2019)
- Masamoto Y, et al., Kurokawa M. (10人中10番目) Adiponectin enhances antibacterial activity of hematopoietic cells by suppressing bone marrow inflammat Immunity 44, 1422 (2016)
- Koya J, et al., Kurokawa M. (11人中11番目) DNMT3A R882 mutant interacts with polycomb proteins to block hematopoietic stem and leukemic cell differentiation. Nature Commun 5, 4770 (2014)
- Kagoya Y, et al., Kurokawa M. (10人中10番目) NF-κB/TNF-α positive feedback loop with active proteasome machinery supports myeloid leukemia initiating cell capacity. J Clin Invest 124, 528 (2014)
