H3K4メチル化酵素活性による白血病非ゲノム情報複製機構の解明
研究内容
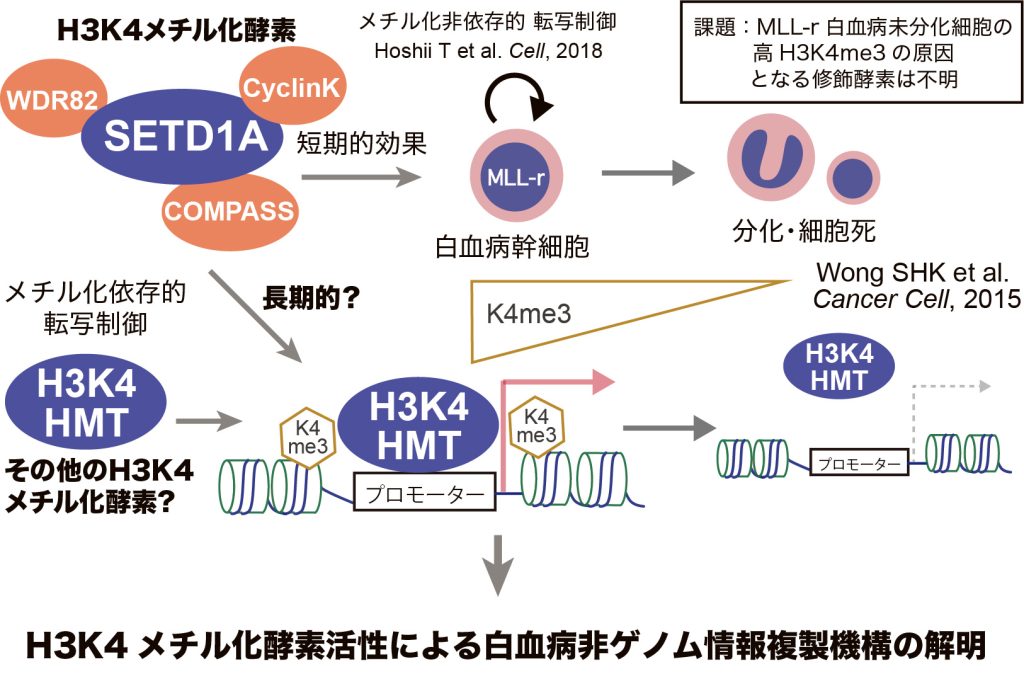
エピジェネティクスでは修飾や酵素が真核生物間で非常に良く保存されていることから、酵母が高等真核生物の縮図として非常によく研究されている。一方で高等真核生物ではゲノムの肥大化と遺伝子数の増加に伴い、エピゲノム酵素は多様性を獲得しているが、その役割や意義は十分に解明されていない。例えば酵母では単一のH3K4メチル化酵素(HMT)であるSet1が全てのヒストンH3K4メチル化状態を決定するが、ヒトでは10以上の酵素がH3K4 HMTとして分類されている。逆遺伝学的解析から活性の類似した酵素も生物学的役割は大きく異なることが明らかとなってきた(Sugeedha J et al. 2020, Epigenetics)。MLL転座型急性骨髄性白血病の再発に関わる未分化型白血病細胞ではヒストンH3K4トリメチル化の著しい亢進が認められる(Wong SHK et al. 2015, Cancer Cell)。申請者はshRNAライブラリによる機能性H3K4 HMT複合体解析から、酵母Set1と最もドメイン構造の類似したKMT2F(SETD1A)が白血病細胞の生存と未分化性維持に必須であることを見出した(Hoshii T. 2018, Cell)。しかしながら、白血病細胞においてはKMT2Fのメチル化活性よりも新規機能ドメイン(FLOS)とCyclin Kとの結合がHMT活性非依存的に転写を制御することを報告した。KMT2F FLOSドメインの機能的重要性から生体内白血病幹細胞制御における長期的なHMT活性の役割は十分に解析出来ていない。そこで、本研究ではin vivo白血病で働くH3K4 HMTを機能的に評価する。In vivoで高いH3K4メチル化の原因となる酵素を同定し、機能ドメイン解析結果から非ゲノム情報複製機構を標的とする白血病の治療標的創出を目指す。
主な論文
1) Tadokoro, Y., Hoshii, T., et al., (17人中2番目) Spred1 Safeguards Hematopoietic Homeostasis against Diet-Induced Systemic Stress. Cell Stem Cell. 22, 713 (2018)
2) Hoshii, T., et al., Armstrong, SA., (10人中1番目) A non-catalytic function of SETD1A regulates Cyclin-K and the DNA damage response. Cell. 172, 1007 (2018)
3) Hoshii, T., et al., Hirao, A., (14人中1番目) Loss of mTOR complex 1 induces developmental blockage in early T-lymphopoiesis and eradicates T-cell acute lymphoblastic leukemia cells. Proc Natl Acad Sci U S A. 111, 3805 (2014)
4) Hoshii, T., et al., Hirao, A., (10人中1番目) mTORC1 is essential for leukemia-propagation but not stem cell self-renewal. J Clin Invest. 122, 2114 (2012)
5) Naka, K†, Hoshii, T†., et al., (9人中2番目) TGF-beta-FOXO signalling maintains leukaemia-initiating cells in chronic myeloid leukaemia. Nature. 463, 676 (2010)
