ヒストン修飾Eraserによる抑制的エピゲノムの維持・変動制御機構の解明
研究内容
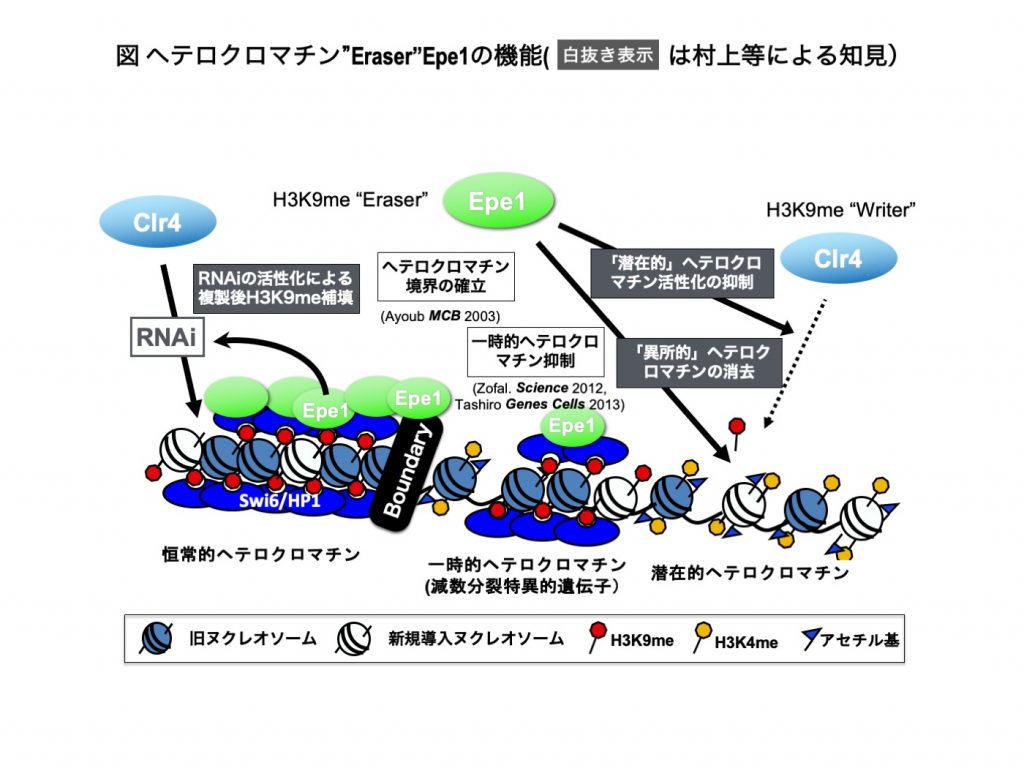
細胞分化・自己複製におけるエピゲノムの維持と変化にはクロマチン構造を規定するヒストン修飾酵素(Writer)および脱修飾酵素(Eraser)の協調的制御が重要である。しかし、Eraserの機能はほとんど明らかではない。我々はヒストンH3K9メチル化(H3K9me)で規定されるヘテロクロマチンに基づく抑制的エピゲノムの維持・変動機構を優れたモデル生物である分裂酵母を用いて解析している。その中でH3K9me-EraserであるEpe1がヘテロクロマチンを統合的に制御していることを見いだした(図) 。ゲノム上には潜在的なヘテロクロマチン形成部位が散在し、偶発的にヘテロクロマチンを形成し表現型の変化を引き起こす。Epe1はEraserとしてこの異所的ヘテロクロマチン(ectopic heterochromatin: EHC)を除去するだけでなく、脱メチル化活性非依存的にEHC形成を積極的に阻害する。一方Epe1は構成的ヘテロクロマチンに局在し、G2期にRNAiに依存するヘテロクロマチン形成を活性化し次のS期の前に十分な量のH3K9meを蓄積することでヘテロクロマチンの安定維持を促している。本研究では以下の点を明らかにする(1) 遺伝学・生化学・構造解析等を駆使して、上記Epe1によるヘテロクロマチン制御の分子機構を解明する。(2) 分裂酵母では環境変化、有性生殖過程への分化の時にユークロマチンに存在する一時的ヘテロクロマチンが変動する。この時にEpe1が果たす役割を明らかにする。(3) 分裂酵母でみられたEraserによる抑制的エピゲノム制御機構(Writerの活性化)がより複雑な生物でも機能するのか、その普遍性について明らかにする。
主な論文
- Sorida M, Murakami Y. (13人中13番目) Regulation of ectopic heterochromatin-mediated epigenetic diversification by the JmjC family protein Epe1. PLoS Genet 15: e1008129. (2019)
- Kotomura, N. et al., Murakami Y.* (7人中7番目) Sfh1, an essential component of the RSC chromatin remodeling complex, maintains genome integrity in fission yeast. (2018) Genes Cells 23, 738–752.
- Kajitani, T., Kato, H., et al., *Muakami, Y. (10人中10番目) Ser7 of RNAPII-CTD facilitates heterochromatin formation by linking ncRNA to RNAi. Proc Natl Acad Sci USA 114, E11208-E11217 (2017)
- Tange Y., et al., Murakami Y* (12人中9番目), Haraguchi, T.*, Hiraoka, Y.*, Inner nuclear membrane protein Lem2 augments heterochromatin formation in response to nutritional conditions. (2016) Gene to Cells 21: 812-832
- Suzuki, S., Kato, H., et al., Takahata, S. *Murakami, Y. (10人中10番目):. Histone H3K36 trimethylation is essential for multiple silencing mechanisms in fission yeast. Nuc Acid Res 44, 4147-4162 (2016)
- Oya, E., Kato, H., *Murakami, Y. (6人中6番目) Mediator Directs Co-transcriptional Heterochromatin Assembly by RNA Interference-Dependent and -Independent Pathways. Plos Genet 9, e1003677 (2013)
- Kawakami, K., Hayashi, A., Nakayama, J-I. and *Murakami, Y. A novel RNAi protein, Dsh1, assembles RNAi machinery on chromatin to amplify heterochromatic siRNA. Genes & Dev 26, 1811-1824 (2012)
- Nakama, M., Kawakami, K., Kajitaini, T., Urano, T. and *Murakami, Y. DNA-RNA hybrid formation mediates RNAi-directed heterochromatin formation. Genes to Cells 17, 218-233 (2012)
- Shimada A., et al. *Murakami, Y. (7人中7番目) Phosphorylation of Swi6/HP1 regulates transcriptional gene silencing at heterochromatin. Genes & Dev 23, 18-23 (2009)
- Dohke K., *Murakami, Y. (6人中6番目) Fission yeast chromatin assembly factor 1 assists in the replication-coupled maintenance of heterochromatin. Genes to Cells 13,1027-43 (2008)
- Kato H., *Murakami, Y. (7人中7番目) Schizosaccharomyces pombe Orc5 plays multiple roles in the maintenance of genome stability throughout the cell cycle. Cell Cycle 7, 1083-1094 (2008)
- Kato, H., *Murakami, Y. (6人中6番目) RNA polymerase II is required for RNAi-dependent heterochromatin formation. Science 309, 467-469 (2005)
- Nakagawa H., *Murakami Y. (8人中8番目) Fission yeast CENP-B homologs nucleate centromeric heterochromatin by promoting heterochromatin specific histone tail modifications. Genes & Dev 16, 1766-1778 (2002)
- Murakami Y., Eki T. and *Hurwitz J.: Studies on the initiation of simian virus 40 replication in vitro: RNA primer synthesis and its elongation. Proc Nat. Acad Sci USA 89, 952-956 (1992)
- Murakami Y., (6人中1番目), *Ito., Y. The nuclear oncogenes c-jun and c-fos as regulators of DNA replication. Natl. Acad. Sci. USA 88, 3974-3951 (1991)
