研究課題名
ヒストンメチル化状態の確立・維持・破綻機構
研究内容
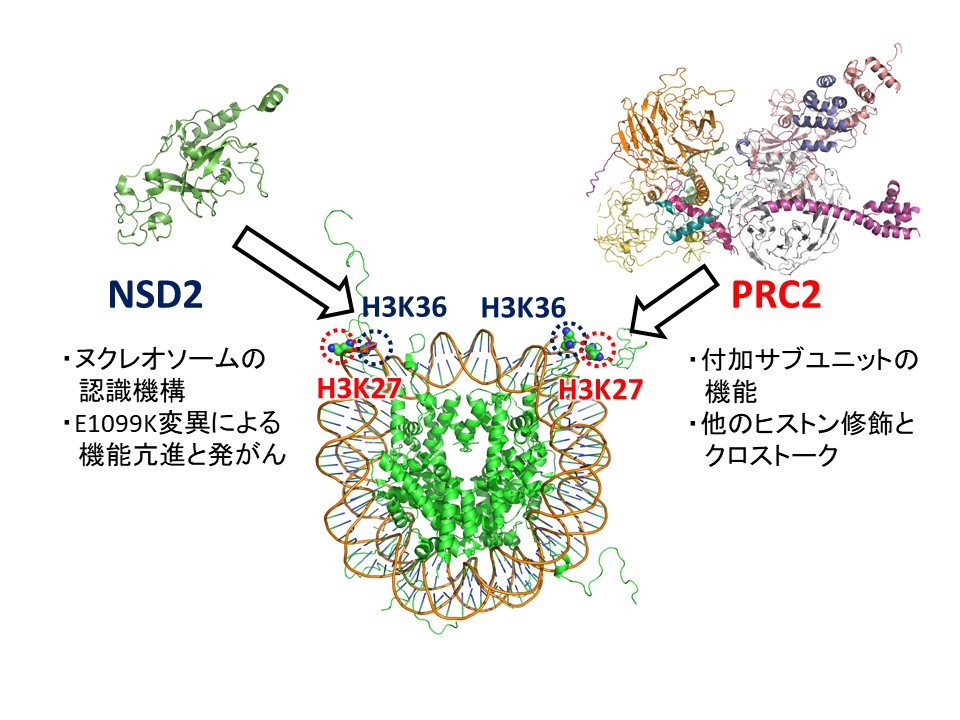
ヒストンは様々な位置のリジン残基でメチル化を受け、それにより異なる生物学的応答が引き起こされます。例えば、H3K36のメチル化は転写領域やintergenic領域に見られ、適切な転写開始点の選択やDNAメチル化などを制御しています。一方、H3K27のメチル化は条件的ヘテロクロマチン形成を誘導し、分化制御遺伝子などの発現を抑制しています。ヒストンメチル化酵素には様々な種類があり、それぞれ特定の位置にメチル基を導入します。これらの酵素は多くの因子によって複雑な制御を受けますが、その制御機構の詳細な理解は進んでいません。また、異常なヒストンメチル化は様々な疾患と密接に関係しています。本研究ではクライオ電子顕微鏡を用いた立体構造解析を行い、2種類のヒストンメチル化酵素(H3K36をメチル化するNSD2/MMSETと、H3K27をメチル化するPRC2)がメチル化状態という非ゲノム情報がどのように確立・維持し、またその制御が病的環境でどのように破綻するかを解明します。生化学的解析から、NSD2は遊離ヒストンに対する活性は弱く、ヌクレオソーム構造を認識してH3K36をメチル化することが示唆されています。また、造血器腫瘍においてNSD2の活性が異常亢進しており、一部の白血病ではこれがE1099K変異によって引き起こされています。ヌクレオソーム環境によるNSD2の正常な活性制御機構と、E1099K変異による病的な活性化機構の解明を目指します。PRC2は複数のサブユニットからなるメチル化酵素複合体であり、コアサブユニットに加えて異なる種類の付加的サブユニットがゲノム上の局在と活性を制御しています。また、ヌクレオソームがH2Aモノユビキチン化されると活性が上昇し、一方H3K36メチル化で活性が抑制されることが分かっています(修飾のクロストーク)。これらの複雑なPRC2機能制御機構の構造基盤を明らかにします。
主な論文
- Niwa H, , Handa N, Sengoku T, Umehara T, Yokoyama S*. Development and Structural Evaluation of N-Alkylated trans-2-Phenylcyclopropylamine-Based LSD1 Inhibitors. ChemMedChem Mar 12 (2020)
- Sengoku T, Suzuki T, Dohmae N, Watanabe C, Honma T, Hikida Y, Yamaguchi Y, Takahashi H, Yokoyama S*, Yanagisawa T*. Structural basis of protein arginine rhamnosylation by glycosyltransferase EarP. Nat Chem Biol 14, 368-374 (2018)
- Tang Z, Chen WY, Shimada M, Nguyen UT, Kim J, Sun XJ, Sengoku T, McGinty RK, Fernandez JP, Muir TW, Roeder RG*. SET1 and p300 act synergistically, through coupled histone modifications, in transcriptional activation by p53. Cell 154, 297-310 (2013)
- Shpargel KB, Sengoku T, Yokoyama S, Magnuson T*. UTX and UTY demonstrate histone demethylase-independent function in mouse embryonic development. PLoS Genet 8, e1002964 (2012)
- Sengoku T, Yokoyama S*. Structural basis for histone H3 Lys 27 demethylation by UTX/KDM6A. Genes Dev 25, 2266-77 (2011)
